摘要
背景与目的:血管周围空间扩张已被证明是年轻痴呆患者大脑小血管疾病的特异性生物标志物。我们的目的是在老年痴呆症患者中检查脑血管周围空间扩张作为小血管疾病生物标志物的鉴别能力。
材料和方法:我们研究了健康的志愿者(n= 65;平均年龄78±5.6岁)和血管性痴呆患者(n= 39;平均年龄76.9±7.7岁)和阿尔茨海默病(n= 47;平均年龄74.1±8.5岁)。我们比较了白质高强度和2种半定量的血管周围空间评分系统(血管周围空间-1和血管周围空间-2)。使用加权Cohen κ统计量来评估观察者内部和观察者之间的一致性。采用多项回归模型评估影像学特征对临床分组的鉴别能力。
结果:血管性痴呆患者的白质高强度评分高于阿尔茨海默病(P< .05)或健康志愿者(P< . 01)。血管性痴呆和阿尔茨海默病患者血管周围空间-1评分高于健康志愿者(P< . 01)。半卵圆椎体血管周围空间2评分组间无差异。然而,基底神经节血管周围空间2在血管性痴呆中高于阿尔茨海默病(P< .05)或健康志愿者(P< .001),阿尔茨海默病的发病率高于健康志愿者(P<措施)。痴呆与健康志愿者、阿尔茨海默病与健康志愿者以及血管性痴呆与阿尔茨海默病的建模显示了血管周围空间2基底神经节作为唯一具有独立显著判别能力的成像参数(P< . 01,P< .01,和P< .05),受试者工作特征曲线下面积分别为0.855、0.774和0.71。血管性痴呆与健康志愿者的建模表明,血管周围空间2基底神经节(P< .01),修改后的Scheltens评分(P< .05)贡献了显著的独立判别力,分别占模型方差的34%和13%。
结论:在老年人群中,扩张的血管周围间隙仍然是小血管疾病的有价值的生物标志物。
缩写:
- 广告
- 阿尔茨海默病
- BG
- 基底神经节
- CSOV
- 椎体semiovale
- 规范
- 健康的志愿者
- pv
- 血管周围间隙扩张
- 中华民国
- 接收机工作特性
- 圣言会
- 小血管疾病
- 通过采用
- 血管性痴呆
阿尔茨海默病(AD)和血管性痴呆(VaD)约占痴呆症的80%。1它们可以单独发生,但更有可能随着年龄的增长而共存。2血管性痴呆本质上是多因素的,可能是由于血栓性或栓塞性大血管闭塞导致的皮层梗死,或更常见的是脑小血管病(SVD)导致脑深部结构和脑白质的缺血性损伤。3.,4虽然磁共振成像可以识别节段性梗死和出血,但迫切需要可靠的SVD生物标志物。5潜在的影像学生物标志物包括深部白质高强度、血管周围间隙扩张(PVS)、腔隙性卒中、脑微出血和脑萎缩。5
组织学上,PVS是中重度SVD的一个特征。6影像学研究表明,它们对与SVD相关的疾病有很高的鉴别能力,包括腔隙性中风,7难治性晚发性抑郁症,8还有血管性痴呆。6在这些病例中,PVS提供了比深层白质高强度评分更大的鉴别能力。一项对32名健康老年受试者的研究也表明,当深部白质高强度评分与弗雷明汉中风风险无关时,PVS评分与弗雷明汉中风风险相关。9
这项研究建立在先前对年轻痴呆症患者的PVS研究的基础上6以及老年腔隙性中风患者。7随着年龄的增长,SVD和血管疾病的影像学特征越来越常见,常见于健康受试者和原发性神经退行性疾病(如AD)患者。这些发现反映在先前作者使用的评分系统中。Patankar等人,6在研究患有早发性痴呆的年轻患者时,他们使用了一种评分系统,根据基底神经节中存在少量PVS来检测早期SVD,得分越高,对应的数量越多,位置越远离大脑表面。在老年人中,贯穿基底神经节的PVS越来越普遍,因此该评分系统的鉴别能力可能会降低。因此,double等人,7比较腔隙性卒中和皮质性卒中老年患者的PVS,使用基于基底神经节和半卵圆椎体任一轴向切面上PVS最大数量的评分系统。
在这项研究中,我们检查了PVS和深部白质高强度作为高龄人群SVD生物标志物的效用,并比较了先前描述的PVS评分系统在区分AD和VaD方面的鉴别能力。
材料与方法
南曼彻斯特当地的研究伦理委员会批准了该项目,所有受试者都知情同意。在护理人员的帮助下,那些没有完全能力的人获得了同意。
病人的选择
我们招募了3组受试者:1)AD, 2) VaD, 3)健康年龄匹配对照组(Norm)。老年精神病学专家在大曼彻斯特进行了临床招募,所有患者都符合痴呆症的标准精神疾病诊断与统计手册阿尔茨海默病患者符合国家神经学和交往障碍研究所以及中风-阿尔茨海默病和相关疾病协会的标准,10血管性痴呆患者符合国家神经疾病研究所和国际中风研究协会血管性痴呆的神经科学标准。11排除AD和VaD混合型及接受抗凝治疗者。12
对照组
对照对象是从登记患者的全科诊所招募的。他们根据年龄、性别和社会经济地位进行了匹配。有显著认知异常的对照组被排除在外(见下文)。为了避免选择偏倚,我们没有将血管危险因素纳入纳入/排除标准。
排除标准
在小型精神状态检查中得分<10(重度痴呆)的患者被排除在外,因为他们被认为不太可能有能力同意这项研究。诊断为痴呆或简易精神状态检查得分<24的对照组被排除在外,因为他们可能有潜在的痴呆或其他认知障碍。此外,MR成像后,T1和FLAIR图像显示无症状梗死的对照组被排除在研究之外。
神经影像学
所有受试者均使用1.5T全身扫描仪和鸟笼头线圈接收器(ACS-NT, Power Track 6000梯度子系统;飞利浦医疗保健,贝斯特,荷兰)。序列包括:1)三维体积流体衰减反演采收率(TR/TE/T1 = 11,000/140/2600 ms,切片厚度= 3.0 mm); 2)三维体积T1加权反演采收率(TR/TE/T1 = 6850/18/300 ms,切片厚度= 3.0 mm)。所有序列的矩阵为256 × 256, FOV为230 × 230 mm。
图像被转移到一台独立的Macintosh个人电脑(Apple, Cupertino, California)工作站,并使用临床工作站应用程序(OsiriX,http://www.osirix-viewer.com).13
图像分析
白质病变评分采用我们实验室之前验证过的改良Sheltens评分。14基于较差的重现性和评分者之间的一致性,壳核和苍白球的独立评分被扁豆状核的综合评分所取代(表1).评分由经验丰富的神经放射学家(A.J.)使用T1反转恢复和FLAIR图像进行。
轴向T1反转恢复图像显示扩张的PVS。虽然大多数研究都使用了大量的t2加权图像,但先前的报道通过使用这种非常严重的t1加权序列证明了PVS的高度显著性。6,8使用了两个先前描述的评分系统。第一种是帕坦卡尔等人在2005年提出的,6计算基底节区总PVS总分为5分(BG;PVS-1BG)和半卵圆中体总分2分(CSOV;PVS-1CSOV).CSOV中,0表示无;1、每边<5条;2 >5在1或者两边。在基底神经节,0表示仅在无名质存在PVS,两侧PVS <5;1、PVS仅分布于无名质,两侧>5扩张;两侧慢状核中有2,0 - 5个PVS;3,5 - 10个PVS在豆状核或0-5个在尾状核两侧;4、两侧豆状核>10,尾状核<5;5,慢状核>10,两侧尾状核>5。 Care was taken to ensure that PVS were not counted twice by following their continuity through sections. PVS-1BG和PVS-1CSOV结合起来形成一个累积评分(PVS-1)。
第二个评分系统改编自double等人,2010年。7BG (PVS-2BG)和CSOV (PVS-2CSOV)分别打分;然后,将这些分数组合起来生成总分(PVS-2)。在每个结构中,选择可见PVS最多的部分,并在数量最多的一侧进行计数。得分如下;0 =无PVS, 1 = 1 - 10, 2 = 11-20, 3 = 21-30, 4 = 31-40,以此类推。原double评分为3 = 21-40,4 (>40 PVS)为最大评分(图1).
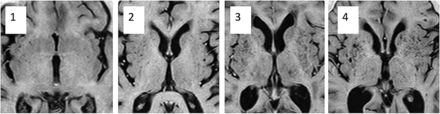
图像显示基底神经节与PVS-2相对应的血管周围空间扩张BG1-4分。
观察者间和观察者内变异研究
进行了初步的观察者间和观察者内变异研究,以评估评分系统各组成部分的可靠性。所有痴呆患者(47例AD患者和39例VaD患者)和前31例健康对照患者(在招募日选定)均被纳入观察者间研究(n= 117)。所有病例由3名经验丰富的神经放射学家随机评分。一名观察员(A.J.)在两次会议之间的7天重复了所有案例的评分。该研究评估了修正Scheltens评分的所有组成部分(表1)14以及之前描述的2种用于存在扩张pv的评分系统。6,7
统计分析
使用SPSS 20.0版(IBM, Armonk,纽约)和InStat (GraphPad Software,圣地亚哥,加利福尼亚)进行统计分析。使用加权Cohen κ统计量来评估观察者之间和观察者内部的协议。κ统计量的解释采用标准定义。一致性强度定义为非常好,κ = 0.81-1.00;好的,κ = 0.61-0.80;中度,κ = 0.41-0.60;κ = 0.21-0.40;κ < 0.20。组间差异的事后检验采用Tamahane检验,显著性调整为P< .01来补偿1型效应。采用Spearman秩相关系数评估各成像变量之间的相关性。
构建了四个数据模型,以评估成像特征对痴呆患者与对照组、VaD患者与对照组、AD患者与对照组以及AD患者与VaD患者的分离的贡献。每个场景的数据都是标准化的z分数。在Wizard Pro中进行多项逻辑回归建模(http://wizard.evanmiller.org/),将诊断作为结局类别(1 = AD, 2 = VaD, 3 = Norm)。如果成像生物标志物评分显示与诊断相关且显著性< 0.05,则将其作为协变量输入模型。然后,根据变量对模型的贡献的显著性,依次从模型中删除变量,直到所有剩余的变量在P< .05水平。患者的年龄和性别作为协变量输入模型。对各模型及ROC曲线下面积使用分类器生成受试者工作特征(Receiver operating characteristic, ROC)曲线,计算观察到的敏感性、特异性及阳性预测值和阴性预测值。
结果
最后一个研究组由151名受试者组成;AD 47例(平均年龄74.1±8.5岁),VaD 39例(平均年龄76.9±7.7岁),Norm 65例(平均年龄78±5.6岁)。人口统计学和成像生物标志物数据显示在表2.观察者之间和观察者内部的变异研究表明,修正的Scheltens、PVS-1和PVS-2评分有很好的一致性(表3).
改良Scheltens评分VaD组高于AD组(P< .01)或Norm (P< 0.01),但AD与Norm之间无显著性差异(图2一个).
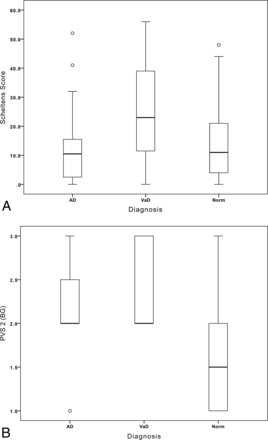
一个,箱线图显示了3个被试组的Scheltens白质评分。B, Boxplot显示PVS-2BG3组受试者基底神经节评分。
VaD和AD组PVS-1评分高于常模组(P< . 01)。半卵圆中体PVS-2评分组间无差异。但VaD基底神经节PVS-2水平高于AD (P< .05)或Norm (P< .001),且AD高于常模(P<措施,图2B).
修正的Scheltens评分,PVS-1 (ρ = 0.334,P< .001), PVS-2 (ρ = 0.347,P在PVS-1和PVS-2之间(ρ = 0.374,P<措施)。
多项回归建模的结果总结在表4.PVS-2BG是唯一具有独立显著判别能力的成像参数(P< .001)以区分痴呆症(VaD和AD合并)患者与健康对照组。ROC曲线下面积为0.855。
AD对Norm的建模也证实了PVS-2BG作为唯一具有独立显著判别能力的成像参数(P< .01), ROC曲线下面积为0.774。VaD与Norm的建模显示PVS-2BG(P< .01),修改后的Scheltens评分(P< .05)贡献了显著的独立判别力,分别占模型方差的34%和13%。由此产生的模型得出ROC下的面积为0.93。最后,VaD与AD的建模验证了PVS-2BG作为唯一具有独立显著判别能力的成像参数(P< .05), ROC曲线下面积为0.71。
讨论
PVS的扩张,特别是基底神经节的扩张,是SVD组织学特征的重要组成部分。6使用MR成像显示PVS与SVD的许多临床特征相关,包括早发人群中的VaD,6迟发性抑郁症的治疗抵抗,8腔隙性中风综合征,15健康人中风的风险也很高9此外,在所有这些病例中,PVS似乎对SVD更特异性,并且比相关白质高强度的严重程度有更大的鉴别能力。使用半定量评分系统对PVS扩张进行了量化,其中2个已被描述。第一个,旨在识别早期轻度-中度SVD,是基于基底神经节中少量PVS的存在和位置,认识到慢状核中的PVS是SVD的早期迹象,并且沿纹丘脑动脉路径更深的PVS的存在表明严重程度增加。6第二种是基于观察,在更严重的SVD中,基底神经节广泛的PVS是常见的,这使得第一个评分系统对患者组之间的差异不敏感,特别是在老年个体中。该评分系统简单地计算了最严重病变部位的基底节区和半卵圆椎体中pv的数量。7
在本研究中,我们研究了深部白质高强度和PVS评分系统区分临床VaD老年患者与健康对照组和AD患者的鉴别能力。在这项研究之前,我们假设PVS的诊断特异性见于患有痴呆症的年轻人群15在无症状受试者中偶发SVD的频率增加的老年患者中会丢失吗5,7,9以及AD患者。3.,16⇓- - - - - -18事实上,我们已经证明,PVS评分在区分VaD、AD和健康受试者方面具有显著的鉴别能力,并且与白质高强度评分相比,PVS评分可以解释组间差异的更大组成部分。尽管PVS-1和PVS-2评分之间有密切的相关性,但PVS-2的判别能力更强,PVS-1没有表现出独立的显著判别能力。
PVS-2的鉴定BG作为老年痴呆患者群体中的一个强大的鉴别器,提供比白质高强度更大的鉴别能力,最初是违反直觉的。血管性痴呆与增加的白质损伤相关的观点似乎得到了观察数据的支持,在血管性痴呆组中,白质高强度评分较高。然而,健康对照组和AD患者之间没有观察到白质高强度评分的组间差异,两者都显示出与以往研究中在健康老年受试者中观察到的值相似。2相比之下,有明确的证据表明,在AD和VaD中,基底神经节的扩张血管周围空间数量显著增加,并且在VaD中有更显著的程度。血管周围间隙扩张是小血管疾病的主要组织学特征,在先前的研究中,在许多疾病状态下,血管周围间隙扩张是小血管疾病存在的一个更具鉴别性的指标。6,8相比之下,尽管深部白质高强度明显与小血管疾病的存在相关,但许多其他病因因素也可能与它们的产生有关。
另一种考虑是,白质评分系统的鉴别能力将取决于对疾病过程中任何给定部分变化的敏感性。在正常衰老和神经退行性疾病中,观察到深部白质高强度,表明脑深部白质病变的倾向,而在皮层下血管性痴呆中,基底神经节和脑干白质病变的频率明显更高。2,5深层白质高强度在Scheltens评分中最多只占24/72,14而本研究中VaD患者的平均Scheltens评分为>22。此外,深部白质高强度评分的增加取决于大病变或融合病变的发展,可能对大量病变的存在不敏感,每个直径< 1cm。14这可能是由于存在广泛的深部白质病变,例如随着年龄的增长而发生的病变,Scheltens评分对严重程度的增加不那么敏感。
结论
总之,这些研究结果表明,即使在老年人群中,PVS扩张仍然是SVD的有用生物标志物,并且在VaD、AD和健康个体之间显示出比白质评分方案更大的特异性。我们的研究结果还表明PVS-2BG评分制在老年人群中更可取。
致谢
作者感谢Nitin Purundare医学博士的主要贡献,遗憾的是他在本研究完成前去世。
脚注
披露:约翰凯恩-不相关的:津贴/补助等待:维康基金会临床奖学金。艾伦杰克逊-相关的:格兰特:惠康信托,*评论:资助初始数据收集和患者招募;不相关的:咨询公司: Hoffmann-LaRoche制药,评论:狮子抗血管生成研究中成像研究的顾问专家。*支付给机构的钱。
参考文献
- 收到了2014年5月14日。
- 修改后接受2014年12月1日。
- ©2015由美国神经放射学杂志